PROPIEDADES
PERIÓDICAS
PROPIEDADES
PERIÓDICAS


QUÉ
SON
Son características de los elementos que varían de manera predecible a lo largo de la tabla. Estas propiedades dependen de la configuración electrónica de los elementos y de su posición en la tabla periódica. Las principales propiedades periódicas son:

RADIO ATÓMICO
Definición: La distancia desde el núcleo del átomo hasta el borde de su nube de electrones.
Tendencia en la Tabla Periódica:
-
Aumenta al bajar en un grupo debido a la adición de niveles de energía.
-
Disminuye al moverse de izquierda a derecha a lo largo de un período debido al aumento de la carga nuclear efectiva, que atrae más los electrones hacia el núcleo.

ENERGÍA DE IONIZACIÓN
Definición: La energía necesaria para remover un electrón de un átomo en estado gaseoso.
Tendencia en la Tabla Periódica:
-
Disminuye al bajar en un grupo porque los electrones están más alejados del núcleo y son menos atraídos por él.
-
Aumenta al moverse de izquierda a derecha a lo largo de un período debido al aumento de la carga nuclear efectiva.
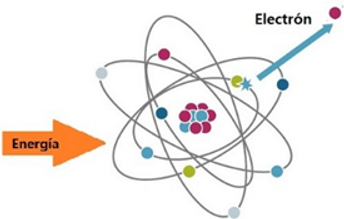
AFINIDAD ELECTRÓNICA
Definición: La cantidad de energía liberada cuando un átomo en estado gaseoso gana un electrón.
Tendencia en la Tabla Periódica:
-
En general, la afinidad electrónica aumenta al moverse de izquierda a derecha a lo largo de un período.
-
No muestra una tendencia clara al bajar en un grupo, pero suele ser menos exergónica (libera menos energía) en los elementos más pesados.

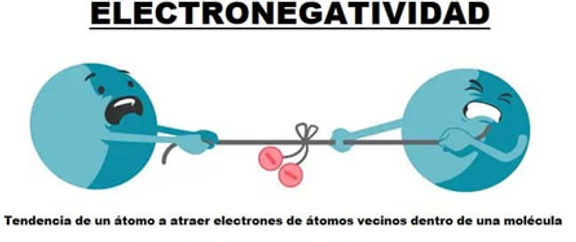
ELECTRONEGATIVIDAD
Definición: La tendencia de un átomo a perder electrones y formar cationes.
Tendencia en la Tabla Periódica:
-
Aumenta al bajar en un grupo.
-
Disminuye al moverse de izquierda a derecha a lo largo de un período.
-
Los metales se encuentran principalmente en la parte izquierda y en el centro de la tabla periódica, mientras que los no metales se encuentran en la parte superior derecha.
CARÁCTER METÁLICO
Definición: La capacidad de un átomo para atraer electrones hacia sí mismo en un enlace químico
Tendencia en la Tabla periódica: Disminuye al bajar en un grupo.
-
Aumenta al moverse de izquierda a derecha a lo largo de un período.
-
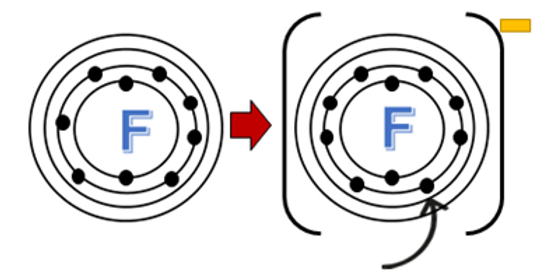
El flúor (F) es el elemento más electronegativo, mientras que los metales alcalinos y los metales de transición tienen electronegatividades más bajas.

CARÁCTER NO METÁLICO
Definición: La tendencia de un átomo a ganar electrones y formar aniones.
Tendencia en la Tabla Periódica:
-
Disminuye al bajar en un grupo.
-
Aumenta al moverse de izquierda a derecha a lo largo de un período.
-
Los no metales se encuentran en la parte superior derecha de la tabla periódica.
RADIO IÓNICO
Definición: La distancia desde el núcleo del ion hasta el borde de su nube de electrones.
Tendencia en la Tabla Periódica:
-
Los cationes (iones positivos) son más pequeños que los átomos neutros de los que provienen, debido a la pérdida de electrones y la disminución de la repulsión entre ellos.
-
Los aniones (iones negativos) son más grandes que los átomos neutros de los que provienen, debido a la ganancia de electrones y el aumento de la repulsión entre ellos.
-
En general, el radio iónico sigue tendencias similares al radio atómico.


USA LA PRESENTACIÓN PARA MÁS INFO
Prueba de la Unidad 2
JUEGA Y APRENDE
