top of page

Teoría de Bohr


En 1913, el físico danés Bohr (1885-1962), dio una explicación al fenómeno que constituye el espectro de emisión de los gases y, en concreto, del hidrógeno.
El electrón se mueve alrededor del núcleo describiendo órbitas circulares.
Principios
El espacio que rodea al núcleo está cuantizado, es decir, hay zonas permitidas, llamadas niveles, y otras que no lo son.

Fórmula


h = Número de Planck
m = masa del electrón
v = Velocidad
r = radio de la órbita
n = número entero

Algunas líneas del espectro son en realidad dos, tres o más, tan próximas que, cuando se observan con instrumentos poco precisos, parecen una sola.

¡Descubre el emocionante mundo del modelo Atómico de Bohr!
Escanea el código QR Y DIVIÉRTETE

Modelo de Someerfeld


En 1915, el físico alemán A. Sommerfeld (1868-1951) propone las órbitas circulares y elípticas a partir del segundo nivel de energía donde están los electrones girando alrededor del núcleo.
El electrón se mueve en una órbita circular y también en una órbita elíptica.

La explicación del principio de incertidumbre de Heisenberg trasladado al mundo macroscópico es como si se quisiera determinar la posición de un automóvil en movimiento haciendo chocar contra él otro automóvil. La determinación final sería poco fiable, ya que el movimiento del primero, velocidad y trayectoria, quedaría modificado por la colisión con el segundo.
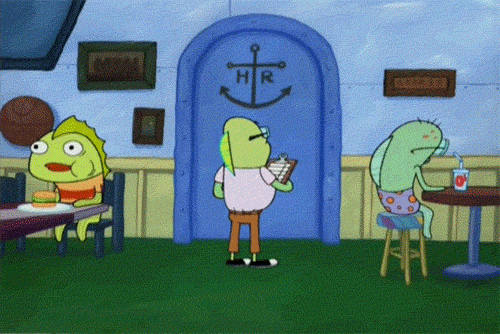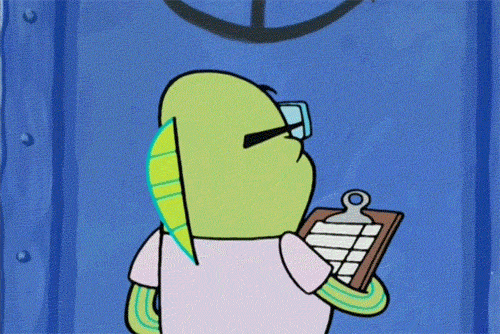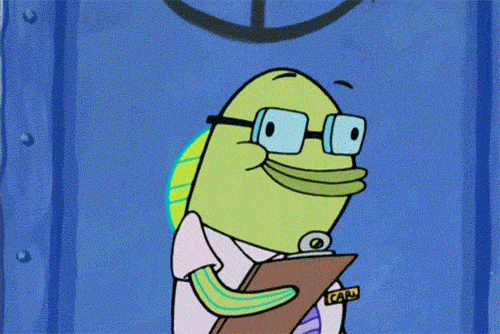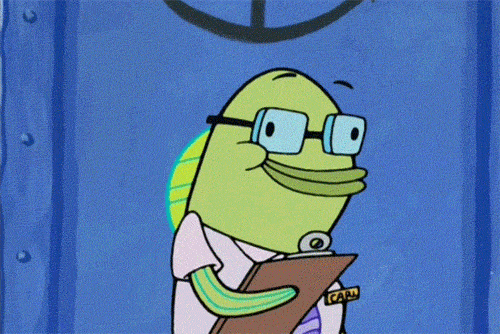

bottom of page