
Balanceo de ecuaciones

En el primer miembro escribimos los reactivos y en el segundo los productos. Si hay varios reactivos o varios productos, los separamos mediante el signo +
Separamos los dos miembros de la ecuación mediante una flecha que indica el sentido de la transformación
Frecuentemente, indicamos el estado físico de las sustancias que intervienen, añadimos los símbolos (s), (l), (g) y (aq)
Características

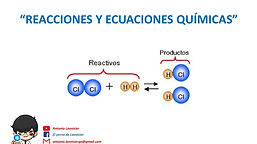

Ajustar una ecuación química consiste en asignar a cada fórmula un coeficiente adecuado de modo que en los dos miembros haya el mismo número de átomos de cada elemento
Método por tanteo
Pasos
Pasos
-
Metales y/o no metales
-
Oxígenos
-
Hidrógenos

Escribe la ecuación con la estructura básica para la reacción
Cuenta los átomos de los elementos de los reactivos
Cuenta los átomos de los elementos de los productos
Cambia los coeficientes para que el número de átomos de cada elemento sea igual en ambos lados
Escribir los coeficientes en su razón más baja posible. Los coeficientes deben ser los números enteros más pequeños posibles.

Nunca cambiar subíndices en una ecuación química

"Mira el video"
"Aprende de forma divertida"

Escanea el código QR Y DIVIÉRTETE

Refuerza el tema con los siguientes ejercicios



Método balanceo algebraico

1.Escribe la ecuación en cuestión
PCl5 + H2O --> H3PO4 + HCl
2. Asigna una letra a cada sustancia.

3. Revisa el número de cada elemento hallado en ambos lados e iguálalos entre sí
•A la izquierda, hay 2b átomos de hidrógeno (2 por cada molécula de H2O), mientras que a la derecha hay 3c+d átomos de hidrógeno (3 por cada molécula de H3PO4 y 1 por cada molécula de HCl). Como el número de átomos de hidrógeno debe ser igual en ambos lados, 2b debe ser igual a 3c+d.
•Haz esto por cada elemento

4. Resuelve este sistema de ecuaciones para obtener el valor numérico para todos los coeficientes
•Para hacer esto con rapidez, toma una variable y asígnale un valor. Por ejemplo, a = 1. A continuación, comienza a resolver el sistema de ecuaciones para obtener los siguientes valores:
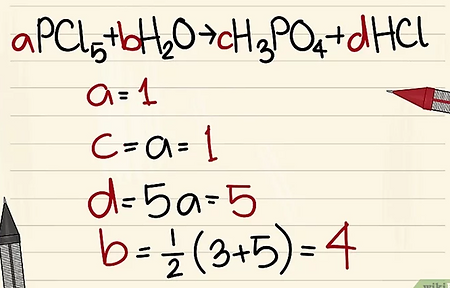
"Mira el video"
Método balanceo ión - electrón
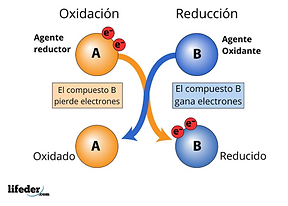

Agente oxidante: Elemento capaz de oxidar a otro y que el mismo sufre una reducción. (Gana electrones)
Agente reductor: Elemento con la capacidad de reducir a otro y que el mismo se oxida. (Pierde electrones)
Pasos
Pasos
Da clic aquí para ingresar a la infografía


"Mira el video"
Método balanceo óxido - reduccón

PASOS
-
Asignamos el número de oxidación de todos los elementos presentes en la reacción y reconocemos los elementos que se oxidan y reducen.
Nota: Todo elemento libre tiene número de oxidación cero.
2. Escribimos las semirreacciones de oxidación y reducción con los electrones de intercambio.

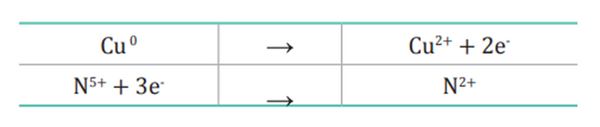
3. Balanceamos el número de átomos en ambos lados de las semirreacciones. En este caso están balanceados.
4. Igualamos el número de electrones ganados y cedidos.

"Mira el video"
Da clic aquí para ingresar a un juego interactivo y así puedas repasar el balanceo de ecuaciones químicas.


